A partir de cette seconde partie, nous allons tenter de mieux comprendre les sens qui nous préoccupent sans doute le plus lors de nos parties de pêche, avec cette éternelle question :
« Est-ce le bon leurre à cet instant de la journée? ».
Une simple (quoique…) question de forme, de couleur, de sonorité et de vibration qui met tous nos sens en éveil lors de nos achats, soumise à l’affectif du pêcheur selon ses expériences mais aussi à des effets de mode.
Depuis quelques années, la tendance étant à la transformation de nos boites à leurres en lampes à bronzer, je vous propose d’aborder la vision de nos carnassiers, tout en gardant en tête que notre perception d’une image est le fruit d’une interprétation par notre cerveau...
 Ces deux grandes billes rondes sont fascinantes, situées de chaque côté du crâne, non protégées par des paupières, elle semblent nous observer fixement. Malgré ces différences, l’œil des poissons est assez proche du notre d’un point de vue anatomique.
Ces deux grandes billes rondes sont fascinantes, situées de chaque côté du crâne, non protégées par des paupières, elle semblent nous observer fixement. Malgré ces différences, l’œil des poissons est assez proche du notre d’un point de vue anatomique.
Un peu d’anatomie...
Ainsi, comme chez l’Homme, nous retrouvons :
La cornée, responsable de l’éclairage de l’œil. Elle est plate avec un indice de réfraction (n= 1.37) proche celle de l’eau (n=1.33) : elle ne réfracte donc pas les rayons lumineux. Ce n’est pas le cas de notre cornée au contact de l’air (n=1) 1.
Le cristallin, le zoom de l’œil. Il est sphérique et quasi indéformable. Ainsi, contrairement au notre, il n’est pas capable de modifier sa courbure afin de réaliser les ajustements nécessaires à la focalisation des objets à toutes les distances 2-3. Les poissons remédient à cela en modifiant la distance entre la rétine au cristallin, mais cette accommodation est limitée.
L’iris, responsable de la couleur des yeux. Certains poissons sont capables de modifier sa couleur suivant le milieu et la présence de proies 4.
La pupille, le diaphragme de l’œil. C’est l’espace au centre de l’iris, dont la variation de diamètre régule la quantité de lumière entrant dans l’œil. Cependant chez les poissons, le cristallin occupe cette partie centrale ce qui limite fortement les mouvements de l’iris 5.
La rétine, le film photographique. Elle est située au fond de l’œil, c’est ici que se forme l’image. Du fait de la présence d’un cristallin indéformable, la netteté de cette image n’est pas toujours optimale chez les poissons.
La rétine est composée de différentes couches cellulaires dont un épithélium pigmentaire, des cellules photoréceptrices (des bâtonnets et des cônes simples/doubles/jumeaux) et des cellules neuronales chargées de transmettre les informations issues des photorécepteurs au nerf optique.
Les bâtonnets sont sensibles aux très faibles éclairements. Ils jouent par conséquent un rôle important dans la vision en faible luminosité et dans la discrimination des contrastes. Ils sont sensibles à une grande partie du spectre visible et permettent de distinguer les objets en niveaux de gris.
Les cônes sont beaucoup moins sensibles que les bâtonnets à la lumière et interviennent donc essentiellement en vision de jour. Les cônes sont les photorécepteurs responsables de la vision des couleurs et de la précision de la vision.
L'organisation rétinienne diffère de manière importante entre les espèces de poissons, le rapport bâtonnets/cônes variant en fonction de leur préférence d'habitat et modes de vie. Les poissons se nourrissant la nuit, en mode crépusculaire, à grande profondeur ou dans des eaux à haute turbidité ont une rétine qui met l'accent sur la sensibilité à la lumière. Par contre, les poissons diurnes vivant à proximité de la surface ont une rétine organisée de manière à privilégier l'acuité visuelle 6.
Illustrons ceci avec nos percidés :
Les cônes des perches (Perca sp.) sont de taille moyenne et la plupart sont situés à proximité du nerf optique, alors que leurs bâtonnets sont relativement grands et uniformément répartis sur la rétine. Cette organisation permet aux perches de disposer d’une acuité visuelle élevée pour des intensités lumineuses modérées ou élevées et adaptée à leur activité dans la partie supérieure de la colonne d’eau.
Le sandre (Sander lucioperca) et ses cousins américains diffèrent de Perca sp., avec des cônes volumineux dispersés sur la rétine et des petits bâtonnets mais organisés en groupes. Cet arrangement assure une excellente sensibilité à la lumière au détriment de l’acuité.
Ainsi, les sandres sont équipés d'un appareil visuel adapté pour se nourrir avec une faible intensité lumineuse en milieu trouble ou en eau plus claire avec une activité nocturne et crépusculaire7.
Ces organisations rétiniennes expliquent, au moins partiellement, le fait qu’il soit plus aisé de déclencher des perches au topwater que des sandres ou l’intérêt de la pêche crépusculaire, voire de nuit pour le sandre. Cependant il faut parfois de ne pas hésiter à prendre le contrepied des schémas stéréotypés ...Des sandres de 70cm en bordure d’herbier dans une eau claire (leurre blanc visible jusqu’à 1.8m) à 23° dans moins de deux mètres de fond sous un ciel bleu non venteux et un soleil au zénith, c’est une expérience espagnole « surprenante », mais qui démontre la formidable capacité d’adaptation de ce carnassier.
Vous vous rappelez que la pupille des poissons ne peut assurer un rôle de diaphragme, cependant la structure rétinienne fait preuve d’une certaine plasticité ce qui permet au poisson de s'adapter aux variations du flux lumineux dans leur environnement. Cette fonction est appelée réponse rétinomotrice, elle peut se décrire comme la capacité de masquage pigmentaire par les cellules épithéliales rétiniennes et les capacités de contraction/étirement des bâtonnets et des cônes en réponse aux changements d’intensité de la lumière ambiante 7.
Chez la perche (Perca sp.) 7, le saumon de l’Atlantique (Salmo solar) 8 et le black bass (Micropterus salmoides) 9 les bâtonnets et les cônes sont mobiles, alors que chez les sandres (Sander lucioperca, S. vitreum et S. canadensis) 7 seuls les bâtonnets sont mobiles. Dans tous les cas , la réponse rétinomotrice est lente (plusieurs dizaines de minutes) et n’est donc pas adaptée à des brusques changements de luminosité, comme notre pupille.
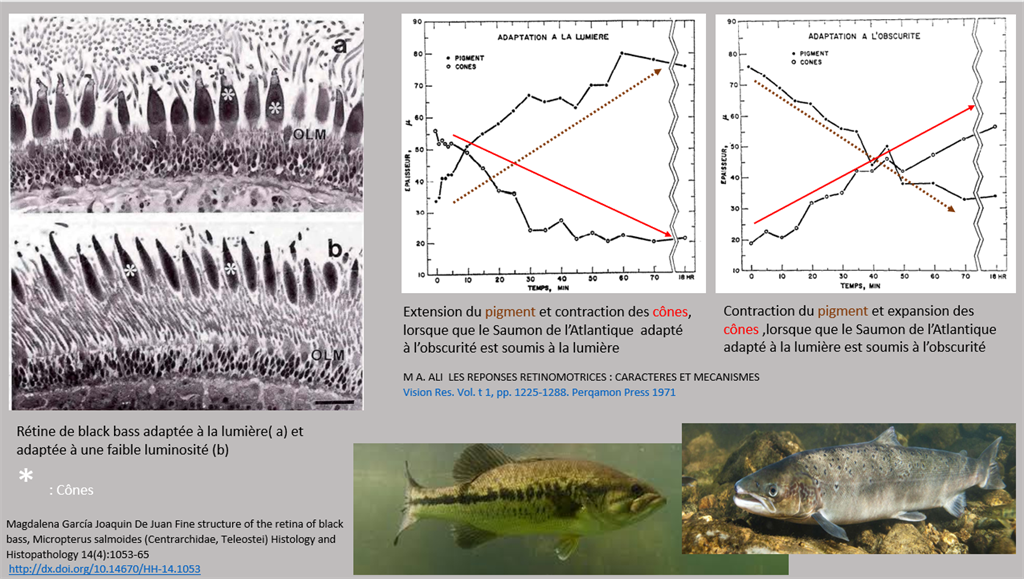
Enfin, certains poissons dont le sandre disposent d’une structure particulière dans leur rétine : le tapetum lucidum ou tapis clair. C’est une couche réfléchissante située dans l'épithélium pigmenté qui améliore la sensibilité à la lumière dans des conditions sombres. Le tapetum lucidum isole optiquement des groupes de bâtonnets. Cette disposition induit une réflexion de la lumière blanche (sur toute la largeur du spectre 450-750nm) en arrière et entre les bâtonnets avec pour conséquence une augmentation de la quantité de photons stimulant ces bâtonnets.
L'arrangement et la distribution du tapetum lucidum chez les percidés diffèrent quelque peu entre les espèces en fonction principalement de leur mode de vie, il est absent chez Perca sp..
Dans le genre Sander sp., le doré noir (S. canadensis) est probablement l'espèce avec le tapetum lucidum le plus développé, uniformément réparti sur toute la rétine 10. Le sandre (Sander lucioperca) a un tapetum lucidum limité aux deux tiers dorsaux de la rétine. Par contre, ventralement, là où la majeure partie de la lumière est concentrée, il dispose d’une densité de cônes simples plus élevée que le doré noir assurant une acuité visuelle accrue dans la partie la plus éclairée de la rétine 11.
A la vue… de ces différentes particularités de l’œil de nos carnassiers, nous pouvons avancer que :
1. Leur cristallin les fait vivre dans un brouillard permanent, plus ou moins épais,
2. Leurs cellules photoréceptrices sont capables d’assurer la perception des contrastes avec des nuances de gris et suivant les espèces, des couleurs dans le spectre visible par l’humain,
3. Le tapetum lucidum prédispose certaines espèces à une activité crépusculaire, nocturne, aurorale et en eaux chargées.
4. La rétine de notre sandre affiche un excellent compromis entre perception des contrastes et des couleurs.
De l’œil à la vision...
Avant d’aller plus loin dans les applications halieutiques, il reste un dernier point à souligner : si l’œil participe à la vue, il ne fait pas la vision... les capacités visuelles dépendent également de la position des yeux sur la tête, de la transmission de l’influx nerveux au cerveau et c’est ce dernier qui délivre la vision !
Chaque œil travaille de manière indépendante (= vision monoculaire) sur une demi sphère latérale de 180° (150° vers l'avant pour l'homme ) et détecte un objet plus ou moins éloigné (de 10 à 15 mètres) en fonction de la clarté de l'eau. Cette vision monoculaire en 2D ne permet pas d'apprécier le relief ou la distance, mais c’est un excellent détecteur de mouvements, avec une zone aveugle sous et en arrière du poisson.
Le chevauchement des deux demi sphères des champs monoculaires vers l'avant et vers le haut de l’ordre de 30°/40° permet la vision binoculaire (120° chez l’homme et des chiffres supérieurs sont parfois donnés pour le brochet, mais je n’ai trouvé aucune biblio sérieuse sur maître Esox). Elle est donc étroite et restreinte chez nos poissons. Elle assure une vision nette à courte distance, l’appréciation des distances et éventuellement du relief.
Cependant, cette perception du relief se réalise par l’analyse du cerveau de la projection bilatérale d’une image d’un œil sur les deux hémisphères du cerveau (répartition de l’influx nerveux au niveau du chiasma optique : zone de croisement des deux nerfs optiques). C’est ce que l’on dénomme la vision stéréoscopique ou vision 3D, le degré ultime du développement de la vision binoculaire. Bien que les téléostéens disposent d’un chiasma optique, ils n’ont pas cette faculté de projection bilatérale
12 et
vidéo https://www.youtube.com/watch?v=p4K0CRAPXGI .
Enfin, l’acuité visuelle des poissons (faculté de percevoir les détails) est pour les individus les plus performants équivalente à la moitié de notre acuité 13.
Grâce à un large champ visuel, les poissons sont capables de détecter le moindre mouvement dans un angle horizontal de plus de 330° . Un mouvement, c’est une proie potentielle qui devra être ajustée en vision binoculaire pour être acceptée ou refusée.
Avec un champ de vision binoculaire orienté préférentiellement en avant et vers la partie supérieure de la tête, un leurre évoluant au-dessus du prédateur sera toujours plus pêchant qu’un leurre présenté trop bas. De même, lorsque l’on souhaite prospecter une zone, débuter par les couches d’eau supérieures est l’option à privilégier, en l’absence d’informations supplémentaires.
Avec une acuité visuelle moyenne, si les leurres hyper détaillés, voir 3D sont très attractifs pour notre regard, ils ne sont pas aussi sexy aux yeux de nos carnassiers plus aptes à différencier des formes et des contrastes en mouvement.
De la vision à la Strike Zone...
La zone de frappe peut se définir comme l’espace délimité par la distance maximale qu’un carnassier est prêt à parcourir pour capturer une proie. Cette zone évolue en permanence, elle est influencée par de multiples facteurs comme la température, la couverture nuageuse, la turbidité de l’eau, le vent, l’habitat, l’état de satiété du prédateur, la pression de pêche, etc...
Le schéma ci-dessous avec le black bass illustre partiellement l’évolution de la zone de frappe suivant les conditions d’eau (données en pied converties en mètres)... Pour la petite histoire, la distance minimale proposée de 0.15m en milieu sombre correspond au point proche d’un gros bass à 13.5cm : le punctum proximum c’est-à-dire la distance minimale où l’œil est capable de voir distinctement un objet en vision binoculaire 14.
Ce schéma est quelque peu réducteur, et il convient de le replacer dans un espace tridimensionnel où la vision latérale (entre 10-15mètres en eau claire et associée à d’autres sens ) assure la mise en alerte du prédateur, qui va se déplacer pour mettre « la chose en mouvement » dans son champ de vision bilatérale afin de l’analyser et de prendre la décision d’initier ou non une attaque .
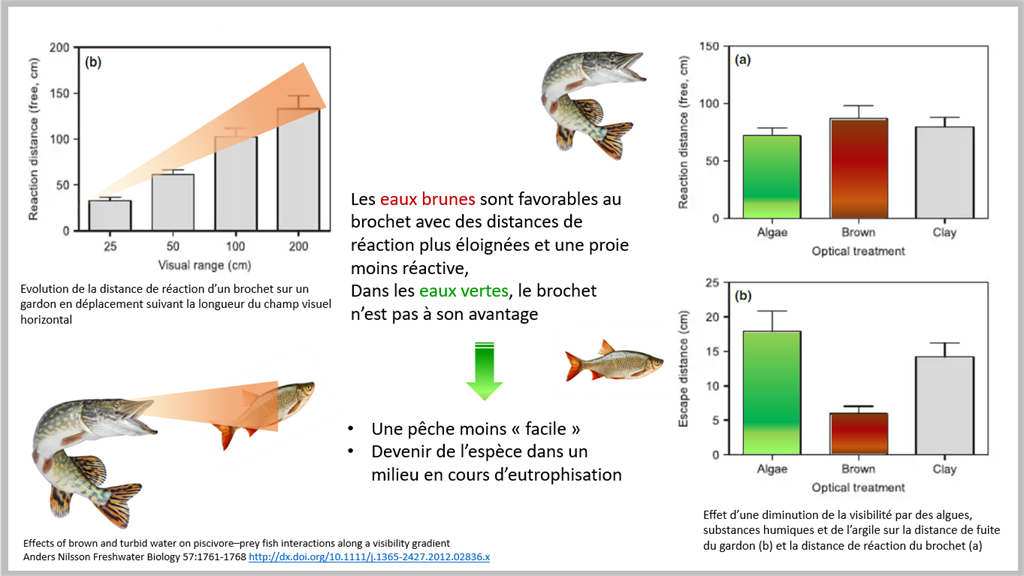
Mais il va dans le sens d’études de terrain ou de laboratoire mettant en avant l’influence de la turbidité ou de la couleur de l’eau sur les distances de réaction ou de fuite des poissons :
La distance de réaction du brochet à la présence d’une proie est affectée par les conditions optiques de l'eau : elle diminue fortement avec l’augmentation de la turbidité (algues, argiles en suspension) et dans une moindre mesure avec la coloration du milieu (eau brune). De la même manière, les distances de réaction du gardon à la présence du brochet sont influencées par les conditions optiques surtout dans les eaux très humiques où les longueurs d’onde courtes (UV et bleues) sont fortement absorbées. Ceci perturbe l’acuité visuelle du gardon, qui, contrairement au brochet, dispose de cônes sensibles aux UV et au bleu.
La seconde phase du comportement alimentaire, représentée par la distance de frappe n’est pas influencée par la portée visuelle (en général, elle est égale à la longueur du corps du brochet) 13.
Enfin, si le taux de réussite des attaques n’est pas modifié par un gradient de turbidité, dans des milieux humiques, une diminution de la coloration brune des eaux s’accompagne d’une augmentation du taux d’échec des attaques. Ceci s’expliquerait, en partie, par le fait que dans l’eau très humique la portée visuelle est égale ou inférieure à la distance de frappe, que les distances de fuite sont réduites (cf. supra) et que profitant de sa coloration cryptique, le brochet à l’affût peut lancer son attaque avant que la proie ne détecte sa présence.
Concernant la sélectivité de la taille des proies (pour des brochets de 35cm), elle est orientée sur des petites proies en eau limpide et humique (6-13cm), mais en eau turbide elle tend à disparaitre avec des attaques sur un plus large panel de taille (6-21cm)14. Ces différences trouvent leur explication dans le fait qu’en raison de ses propriétés optiques, la turbidité est responsable d’une plus grande dégradation de l’information visuelle par diffusion de la lumière que l’eau humique ne le fait par absorption.
Le sandre est susceptible de modifier sa pression de sélection suivant la période du jour, mais aussi en fonction de la couleur des eaux.
Un changement de sélectivité de la perche au gardon est observé chez des sandres (taille moyenne 35cm) lorsque les conditions optiques se dégradent avec la diminution de l'intensité lumineuse jour/nuit, mais également en présence d’eau claire ou brune.
Si l’eau devient moins teintée, la portée visuelle s’améliore et le gardon commence à s'échapper à des distances (40cm) supérieures aux distances d'attaque du sandre (inf. ou égale à 8cm), tandis que la perche ne modifie pas ou peu sa distance de fuite (10cm) facilitant sa prédation par le sandre. Ici, c’est le changement du comportement anti-prédateur qui modifie les schémas de sélectivité 15.
Ces exemples nous suggèrent quelques principes de base dans nos approches de la strike zone suivant les conditions d’eau.
Dans des eaux claires, si la discrétion est de rigueur, il est possible de faire réagir un carnassier de plusieurs mètres sur un leurre. Le brochet constitue l’exemple type lorsque l’on pêche en pélagique. J’ai souvenir d’une session où nous avions repéré au sondeur des individus en maraude dans les 9 mètres. Nous abordons la zone de manière assez classique en prospectant les 7/8 mètres, mais après une demi-heure ....rien : poisson inactif, mauvaise couleur, mauvais choix de vibrations ? Finalement, sans changer de leurres nous déclencherons les attaques en passant plus haut dans la couche d’eau : dans les 5 mètres, alors que des échos sont toujours dans les 9.
Avec la turbidité, si les poissons deviennent moins méfiants, la strike zone se réduit et il faudra aller au contact du poisson. Quelques dizaines de centimètres trop à droite ou trop haut et notre leurre passe en dehors de la strike zone surtout avec les sandres et les black bass dont les distances de frappes sont réduites. Insister sur la zone peut être la solution, mais avec les gros sujets, vous aurez rarement droit à une seconde chance. Sur les postes encombrés, il ne faudra pas hésiter à pénétrer dans les structures et sur des zones plus ouvertes, à resserrer l’éventail de ses lancers ainsi que les niveaux de prospection dans la colonne d’eau.
Si eaux boueuses vous fait immédiatement penser « pêche du sandre en période de crue », c’est un sujet un peu à part. Plus simplement , prenons l’exemple des bordures battues par le vent où les vagues vont mettre en suspension des particules de terre sur une bande d’eau plus ou moins large. Cette zone réserve souvent de belles surprises, mais la précision du lancer devient le facteur clé de la réussite. Soigner son poser au plus près de la berge, être vigilant au premier tour de manivelle puis dans la zone de transition eau trouble/eau claire, s’avèrera souvent payant.
Concernant les leurres, en règle générale, nous associons des coloris à des conditions d’eau et de lumière afin de faciliter leur détection. Ne négligeons pas l’influence de ces conditions sur le comportement anti prédateur des proies, avec pour conséquence des carnassiers susceptibles de se focaliser sur des espèces différentes en raison de leur facilité de capture. Enfin en eau claire, la taille du leurre sera un critère à prendre en compte rapidement en l’absence de touche, les eaux turbides autorisant une marge plus importante dans la sélectivité des proies.
De la vision à la couleur du leurre...
La lumière...c’est l'ensemble des ondes électromagnétiques visibles par l'œil humain, c'est-à-dire comprises dans des longueurs d'onde de 400nm (violet) à 700nm (rouge). La lumière est intimement liée à la notion de couleur. La sensibilité des photorécepteurs à la lumières est assurée par différents pigments visuels.
Ces pigments possèdent des sensibilités variables à travers le spectre, un profil d’absorbance en forme de cloche dont le pic défini leur sensibilité maximale.
Les bâtonnets (R =Rod) sont indispensables à la vision en faible luminosité, notamment dans la pénombre. Ils nous donnent une vision imprécise, en niveaux de gris, de notre environnement.
Les cônes répartis en diverses catégories présentent chacun une sensibilité spécifique à une région du spectre des couleurs.
Chez l’Homme, il existe trois catégories de cônes : on parle de trichromatie avec des cônes sensibles à la lumière bleue (cônes S ou SW2), d'autres à la lumière verte (cônes M) et le troisième type de cônes à la lumière rouge (cônes L). Bien que ces régions soient centrées sur les trois couleurs primaires, elles se chevauchent de manière importante. Les trois types de cônes seront donc stimulés à des degrés divers par une couleur donnée. Ainsi, une couleur bleu ciel va surtout exciter les cônes bleus, mais également les verts à un degré moindre et très légèrement les rouges. Une lumière jaune ne stimulera que les cônes rouges et les cônes verts. La perception des couleurs dépendra donc de la combinaison de ces stimuli 16.
Si certains poissons sont trichromates (possédant trois types de cônes : L,M, SW2), d’autres sont quadrichromates (le quatrième type de cône (SW1) étant sensible aux UV), cependant (la dichromatie semble être privilégiée chez les prédateurs.
En eau douce, le type SW1 est présent chez certaines espèces, comme les salmonidés, cyprinidés ou percidés. Mais c’est surtout en tant que juvéniles durant leur période zooplanctivore que la vision spécifique de l’UV est effective 17-18-19-20-21 . Si certaines espèces conservent ces cônes UV au stade adulte comme les cyprinidés, ceux qui vont prendre de l’expansion dans la chaîne alimentaire en passant du zooplancton à des proies opaques et plus grosses perdent cette vision UV, sauf si elle est utilisée à d’autres fins, comme la communication. Ainsi, pour la truite arc en ciel, le retour sur les zones de reproduction s’accompagne d’une régénération des cônes UV 22.
Voici les spectres d’absorption du gardon et de quatre carnassiers :
Quelles informations tirer de ce tableau ?
- Avec les bâtonnets, le décalage de sensibilité vers des longueurs d’onde plus courtes (vs 550nm), selon les espèces, illustre leur préférence d’habitat, procure un avantage dans la prédation en milieux profonds et dans leur positionnement en dessous des bancs de fourrage.
- Pour les amoureux des poissons spécifiquement sensibles aux UV, je vous conseille de revenir à vos premiers amours en culotte courte : le gardon, voir la carpe. Non, je déc..., quoique, nous reviendrons sur le sujet.
- Le bleu n’est pas la couleur la plus stimulante pour les cônes nos carnassiers. Pour le Black Bass, une étude évoque sa sensibilité au bleu (via des mesures de potentiels électriques dans 458-535nm et non la présence de cônes), mais conclu à sa difficulté de percevoir le bleu 26. Mais, encore une fois, ceci ne veut pas dire qu’un carnassier n’attaquera pas un leurre à dominante de bleu ! Cette zone interviendra dans le contraste en niveaux de gris du leurre et pourra stimuler des cônes M (dans la zone de faible absorbance représentée par la partie de gauche de la courbe en cloche, cf. graphe infra).
- Pour le rouge : en observant le gradient des valeurs de longueurs d’ondes suivant les espèces, on comprend mieux la pertinence du pompon rouge vif sur une cuillère pour le brochet, du rouge-orangé sur les percidés, et du orange/jaune sur le sandres.
- Le vert, est situé au milieu du spectre visible. Je dirai que c’est la gamme couleur dominante passe partout, susceptible de répondre à toutes les situations, en passant du green pumpkin au chartreux (vert ou jaune, le chartreux est sans doute, le flashy indispensable pour le sandre assurant le complément couleur, avec la couleur du fond et de l’eau du milieu pêché ).
- Enfin, si nous essayons de composer au maximum avec la sensibilité des cônes M,L, et le contraste (via une couleur achromatique : le noir), nous obtenons : le fire tiger dont la réputation n’est plus à démontrer, à essayer en toute condition d’eau ! Une base de coloris à l’origine de mes records sandre et black bass, et sur les perches dans des eaux brunes, une cuillère N° 5 tournante en FT, c’est une valeur sûre.
Attention à ne pas trop simplifier les choses...Tout d’abord, la perception d’une couleur ne signifie pas son attractivité. Ensuite cette perception résulte de la stimulation plus ou moins élevée, d’une ou plusieurs séries de cônes à partir d’une ou plusieurs longueurs d’onde. Ainsi certaines couleurs que nous, les trichromates différencions clairement pourront être plus confuses dans l’esprit de nos prédateurs...
Ahah, là...vivement que nous retournions aux bords de l’eau sans nous poser tant de questions !
Allez, on continue avec un poisson qui monte : le Black Bass.
Son spectre visuel laisse entrevoir plusieurs hypothèses sur sa perception des couleurs et qui semblent se confirmer dans une étude comportementale avec des poissons éduqués sur 6 couleurs cibles différentes par une récompense alimentaire et placées à la surface de l’eau 24.
Avec le graphe de la réflectance des couleurs cibles, vous constater qu’un objet noir qui absorbe 100% de la lumière visible donc toutes les couleurs, présente un réflectance nulle. A l’opposé, un objet blanc reflète 100% de la lumière blanche et n’absorbe aucune longueur d’onde visible. Vous avez également remarqué le pourcentage de réflectance de 250% du jaune chartreuse. Cela se produit en raison des propriétés fluorescentes du chartreuse jaune, où les photons UV sont absorbés puis émis à une longueur d'onde plus longue.
Après la période d’éducation, leur capacité à différencier cette couleur cible parmi d’autres couleurs, ou des couleurs achromatiques similaires en luminosité a été évaluée :
Cet exemple met en avant la capacité du bass à garder en mémoire certaines couleurs, le rouge est une valeur sûre pour le Bass. Sur des lieux à forte pression de pêche, cette faculté d’éducation n’est pas sans conséquence sur leur comportement. Avec des bass devenus méfiants sur des coloris « suspects » : une solution sera de jouer la carte du naturel au maximum.
Au moment de composer sa première boite de pêche, choisir entre des leurres noirs et des bleus n’est pas de première importance (un petit avantage au noir), par contre disposer d’une gamme de leurres noirs (ou bleu) avec des paillettes ou des incrustations de différentes couleurs devrait faire le job
Malgré le caractère UV du jaune chartreuse, les bass ont du mal à le différencier du blanc, en effet ces deux couleurs stimulent les cônes verts et rouges à des fréquences similaires, ici dans une eau claire et en surface.
Peut-être un problème de contraste des cibles en surface ou d’éblouissement, me direz-vous ? Besoin d'une paire de lunette de soleil ?
Ne rigolez pas.. 😊Si le sandre et le black bass ne disposent pas d’un tel équipement , la perche et le brochet ont des cornées colorées qui absorbent de manière importante sous 500nm afin de protéger leur rétine des longueurs d’ondes courtes optiquement nocives23. Mais selon le Dr Keith Jones, l’humeur vitrée (gel situé entre le cristallin et la rétine) du black bass absorbe fortement les longueurs d’onde courte sous 450nm 27. Restons objectif, fortement (de l’ordre de 80%) ne signifie pas complétement...
Pour résumer :
La sensibilité visuelle des poissons est dépendante d’un certain nombre de facteurs.
Premièrement, l'œil peut disposer de filtres comme la cornée, le cristallin ou l'humeur vitrée. Ces filtres absorbent généralement les longueurs d'onde les plus courtes, telles que les UV. C’est le cas du brochet, de la perche et du black bass, le sandre semble faire figure d’exception.
Deuxièmement, les photorécepteurs rétiniens peuvent varier en nombre, en type et en disposition, tous ces facteurs peuvent affecter la sensibilité et l'étendue de la discrimination des couleurs. Nos quatre carnassiers sont des dichromates, avec deux pics de sensibilité centrés sur le vert et le rouge.
Troisièmement, les sensibilités des photorécepteurs sont définies par des pigments visuels dans le photorécepteur ; ces pigments visuels ont des profils d'absorbance similaires, en forme de cloche (y compris un pic latéral supplémentaire sensible aux ultraviolets ou une bande bêta pour tous les pigments visuels) 28. Ce pic latéral d’absorption est réduit, mais il est mis en avant par les pro UV (23) pour évoquer non pas une perception, mais une sensibilité aux UV des poissons ne disposant pas de cônes spécifiques. Le sandre pourrait être le meilleur candidat à la sensibilité aux UV.
Ainsi, pour la perception d’ une couleur UV entre l’absence de cônes sensibles et des filtres absorbant les longueurs d’onde sous 500 nm, cela devient compliqué pour certains de nos prédateurs au stade adulte ! Cependant la présence d'un pic latéral de sensibilité ne permet d'exclure à 100% l'intérêt de l'UV, mais son importance doit être relativisée pour au moins trois de nos quatre carnassiers.
UV what else...?
Nous sommes tous attirés par ces belles photos sur fond noir de leurres aux couleurs UV...Ainsi, on se plait à s’immiscer dans la tête d’un carnassier, tapis dans l’ombre de son rocher, prêt à bondir sur sa proie nageant en eau trouble tel un ver luisant... de quoi vous mettre en confiance !
En aucun cas, ce n’est de la lumière UV que nous distinguons, mais de la fluorescence (ou de la phosphorescence) provoquée suite à l’éclairage par une lampe dite UV (avec une longueur courte de 365nm, 385nm, 395nm ou 405nm) ou une lumière noire dite de Wood (avec un léger pic spectral dans le violet à 405nm et un pic principal à 375nm).
La fluorescence se produit lorsque des molécules (les fluorophores) absorbent la lumière d'une longueur d'onde plus courte (énergie plus élevée) et émettent immédiatement de la lumière d'une longueur d'onde plus longue (énergie plus faible). Certains fluorophores émettent une fluorescence avec une excitation par la lumière visible, comme un cône de construction orange fluorescent ou un gilet de sécurité 29-30. A la différence d’une substance phosphorescente, le fluorophore ne peut être « chargé » et émettre en l’absence de lumière.
L’utilisation de coloris UV prend sa source dans le Pacifique il y a plusieurs décennies, avant de se transformer en raz de marée en eau douce, des milieux aux propriétés optiques différentes et des espèces avec des spectres visuels très variés.
Pour notre leurre UV, il est souhaitable que le rayonnement solaire UV résiduel touchant la surface, pénètre dans la colonne d’eau jusqu’à sa profondeur de nage...sinon je dirai bénéfice = perte !
Si dans de l’eau cristalline, cette profondeur de nage sera atteinte sans problème, les UV présentant des Za (Za =1% de l’irradiance de surface) à 50 mètres pour 320nm et à 200 mètres pour 380nm, différents facteurs comme la présence de phytoplancton (mesuré par la concentration en chlorophylle), de matière organique carbonée ou l’acidité peuvent fortement réduire leur pénétration (32-33-34-35).
En eau douce, les lacs d’altitude situés au-dessus de la limite des arbres, où les sols organiques sont minces et n'exportent que de petites quantités de substances organiques dissoutes sont des milieux propices à la pénétration des UV. A l’opposé, dans des lacs acides d'origine naturelle (sources volcaniques, tourbières , drainage rocheux acide naturel) ou subissant des activités humaines (drainage minier acide, acidification des lacs et étangs par les pluies, les composés azotés)36, les UV peuvent être absorbés dès les premiers centimètres et disparaître sous 1 mètre d’eau 34.
Ainsi, pour espérer tirer toute la quintessence (si elle existe...) des leurres UV, l’idée répandue de pêcher profond dans des eaux « sombres » n’est sans doute pas la plus pertinente..
Avec un ciel chargé ou dans certains lacs, peigner la surface et les couches superficielles avec des coloris UV sera plus intéressant. A l’inverse, jouer le contraste UV d’un leurre travaillant sur le fond peut rapidement trouver ses limites dès 3 mètres (eaux chargées en matières organiques) ou dans les 5-8 mètres (eaux chargées en phytoplancton).
Disposer de leurres dont l’UV correspond à des longueurs d’onde très proches du visible me semble essentiel. Si on souhaite pousser plus en avant, je dirai même qu’à chaque condition d’eau et de lumière correspond un UV particulier. Une indication qui pourrait être donnée par les fabricants, surtout pour l’eau douce !
Enfin, n’oublions pas que des coloris peuvent être excités par la lumière visible, rien à voir avec l’UV, sans doute plus intéressants et polyvalents dans nos eaux douces pour jouer l’éclaircissement en milieu «sombre » et le contraste, si cher à nos quatre carnassiers...mais ce n’est que mon avis.
Pour le choix des couleurs, il y a déjà pléthore d’articles très intéressants et ce n’était pas le sujet. Alors juste un petit rappel très basique au moment de préparer ses leurres :
l’eau et le fond en couleur de base et une alternative flashy, avec la possibilité de jouer la subtilité de la transparence, ou la force du contraste via l’opacité suivant la luminosité.
Garder en tête que le contraste prime sur la couleur. Faites-vous plaisir avec les couleurs, et n’hésitez pas à sortir de votre zone de confort surtout lorsque les poissons sont mordeurs !
A bientôt pour la 3ème et dernière partie consacrée à deux sens, au moins voir plus importants que la vision : l’ouïe et surtout le 6ème sens : la ligne latérale.
Biblio
1. https://www.gatinel.com/recherche-formation/la-cornee/3
2. PERFECTIONS & IMPERFECTIONS de la NATURE Publié par Marie-Claire Laberge https://slideplayer.fr/slide/10276501/
3. https://dr-leininger.fr/loeil-et-la-vision/anatomie-de-loeil
4. Controlled iris radiance in a diurnal fish looking at prey Nico K. Michiels, Victoria C. Seeburger, Nadine Kalb, Melissa G. Meadows, Nils Anthes, Amalia A. Mailli and Colin B. Jack Published:21 February 2018 https://doi.org/10.1098/rsos.170838
5. https://www.earthlife.net/fish/sight.html
6. W.Munz Visual Pigments Fish Physiology Volume 5, 1971, Pages 1-32 https://doi.org/10.1016/S1546-5098(08)60042-4
7. Retinal development and retinomotor responses in perch, Perca fluviatilis L.
S. A. Guma'a Journal of fish biology 1982 Volume20, Issue5
https://doi.org/10.1111/j.1095-8649.1982.tb03960.x
8. M A. ALI LES REPONSES RETINOMOTRICES : CARACTERES ET MECANISMES
Vision Res. Vol. t 1, pp. 1225-1288. Perqamon Press 1971. Printed in Great Britain.
9. Magdalena García Joaquin De Juan Fine structure of the retina of black bass, Micropterus salmoides (Centrarchidae, Teleostei) Histology and Histopathology 14(4):1053-65
http://dx.doi.org/10.14670/HH-14.1053
10. Photoreceptors and Visual Pigments as Related to Behavioral Responses and Preferred Habitats of Perches (Perca spp.) and Pikeperches (Stizostedion spp.) Journal of the Fisheries Research Board of Canada 34(10):1475-1480 M. A. Ali R. A. Ryder Michel Anctil DOI:10.1139/f77-212
11. FISKERIVERKET RAPPORT (1999) 2: 45-80 Visual ecology of fish - a review with special reference to percids Alfred Sandström http://www.divaportal.org/smash/get/diva2:1455022/FULLTEXT01.pdf
12. Bilateral visual projections exist in non-teleost bony fish and predate the emergence of tetrapods Robin J. Vigouroux, Karine Duroure, Juliette Vougny, Shahad Albadri, Peter Kozulin, Eloisa Herrera, Kim Nguyen-Ba-Charvet, Ingo Braasch, Rodrigo Suárez, Filippo Del Bene and Alain Chédotal SCIENCE • 9 Apr 2021 • Vol 372, Issue 6538 • pp. 150-156 •
DOI: DOI: 10.1126/science.abe7790
13. Effects of brown and turbid water on piscivore–prey fish interactions along a visibility gradient
Anders Nilsson Freshwater Biology 57:1761-1768 http://dx.doi.org/10.1111/j.1365-2427.2012.02836.x
14. Foraging efficiency and prey selectivity in a visual predator: Differential effects of turbid and humic water July 2013 Canadian Journal of Fisheries and Aquatic Sciences 70(12):1685-1690
Mikael Jönsson Lynn Ranåker Anders Nilsson Christer Brönmark http://dx.doi.org/10.1139/cjfas-2013-0150
15. Piscivore-Prey Fish Interactions: Mechanisms behindDiurnal Patterns in Prey Selectivity in Brown and ClearWater Lynn Ranaker, Jens Persson, Mikael Jönsson P. Anders Nilsson , Christer Brönmark
PLOS ONE | www.plosone.org November 2014 | Volume 9 | Issue 11 | e102002
16. https://e-cours.univ-paris1.fr/modules/uved/envcal/html/compositions-colorees/2-lumiere-visible-couleurs/3-3-vision-couleurs.html
17. Evolutionary replacement of UV vision by violet vision in fish
Takashi Tada, Ahmet Altun, and Shozo Yokoyama PNAS October 13, 2009 106 (41) 17457-17462; https://doi.org/10.1073/pnas.0903839106
18. Bowmaker JK, Kunz YW (1987) Ultraviolet receptors, tetrachromatic colour vision, and retinal mosaics in the brown trout (Salmo trutta): Age-dependent changes. Vision Res 27:2101–2108.
19. Browman HI, Hawryshyn CW (1994) The developmental trajectory of ultraviolet photosensitivity in rainbow trout is altered by thyroxine. Vision Res 34:1397–1406
20. Opsin switch reveals function of the ultraviolet cone in fish foraging
Iñigo Novales Flamarique Published:07 February 2013 https://doi.org/10.1098/rspb.2012.2490
21. A chromatic action spectrum for planktonic predation by juvenile yellow perch, Perca flavescens E. R. Loew, W. N. McFarland, E. L. Mills, and D. Hunter
Canadian Journal of Zoology • February 1993 • https://doi.org/10.1139/z93-053
22. Degeneration and regeneration of ultraviolet cone photoreceptors during development in rainbow trout W. Ted Allison,Stephen G. Dann,Kathy M. Veldhoen,Craig Hawryshyn October 2006 Journal of Comparative Neurology https://doi.org/10.1002/cne.21164
23. Photoreceptors and eyes of pikeperch Sander lucioperca, pike Esox lucius, perch Perca fluviatilis and roach Rutilus from a clear and a brown lake
Mirka Jokela-Määttä,Martta Viljanen,Noora Nevala,Kristian Donner,Christer Brönmark
Volume95, Issue1 Special Issue: The Sensory Ecology of FishesJuly 2019 https://doi.org/10.1111/jfb.13759
24. Seeing red: Color vision in the largemouth bass
March 2018Current Zoology 65(1) Lisa Mitchem Shannon Stanis Shannon Stanis Muchu Zhou Ellis Loew http://dx.doi.org/10.1093/cz/zoy019
25. Spectral sensitivity of the perch (Perca fluviatilis) from the Danube
January 2007Archives of Biological Sciences 59(4) Zoran Gačić Aleksandar Bajic Milena Milosevic M. Nikčević http://dx.doi.org/10.2298/ABS0704335G
26. Color vision, accommodation and visual acuity in the largemouth bass
GUNZO KAWAMURA, TOSHIHISA KISHIMOTO Fisheries science 2002 Volume 68 Issue 5 Pages 1041-1046 DOI https://doi.org/10.1046/j.1444-2906.2002.00530.x
27. https://bixxel.media/new-page-63
28. Seeing the rainbow: mechanisms underlying spectral sensitivity in teleost fishes
Karen L. Carleton,Daniel Escobar-Camacho, Sara M. Stieb, Fabio Cortesi and N. Justin Marshall J Exp Biol. 2020 Apr 15; 223(8): jeb19333. doi: 10.1242/jeb.193334
29. https://www.in-fisherman.com/editorial/uv-light-on-ice-and-open-water/369755
30. BASES DE LA FLUORESCENCE Aurélie Le Ru, Ingénieur d’étude CNRS
Agrobiosciences, Interactions et Biodiversité, Plateau d’imagerie, 24 chemin de Borde Rouge
31326 Castanet-Tolosan Cedex https://trigenotoul.com/wp-content/uploads/2014/09/Fluorescence-cours.pdf
31. Rôle des bactéries hétérotrophes dans le couplage des cycles du fer et du carbone dans l'océan Thèse Sep 2012 Marion Fourquez file:///C:/Users/phil5/Downloads/thesis_Fourquez%20(1).pdf
32. UV penetration in the water column VANTREPOTTE V. and MÉLIN F https://op.europa.eu/en/publication-detail/-/publication/6bff9b12-d8bf-4507-a8c4-fe31b2e2e525
33. Ultraviolet radiation in North American lakes: Attenuation estimates from DOC measurements and implications for plankton communities
Craig E. Williamson, Richard S. Stemberger, Donald P. Morris ,Thomas AI. Frost, Steven G. Paulsen Limnol. Oceanogr., 41(5), 1996, 1024-1034 1996, by the American Society of Limnology and Oceanography, Inc https://aslopubs.onlinelibrary.wiley.com/doi/pdf/10.4319/lo.1996.41.5.1024
34. Optical properties and light penetration in a deep, naturally acidic, iron rich lake: Lago Caviahue (Patagonia, Argentina) Gustavo D.Baffico
Volume 43, Issue 6, November 2013, Pages 475-481 https://doi.org/10.1016/j.limno.2013.03.003
35. Behavioral responses - UVR avoidance and vision DINA M. LEECH AND SOFNKE JOHNSEN https://www.academia.edu/4453084/Behavioral_responses_UVR_avoidance_and_vision
36. https://www.environnement.gouv.qc.ca/eau/eco_aqua/lacs_acides/2004/lacs-acides-Qc.pdf